|
|
|
 |
|
 |
|
|
 |
|
 |
GDP型Rab27aによるインスリン顆粒の動態制御
近年の「科学技術重要施策アクションプラン」の重点的取り組みに掲げられているように、増え続ける糖尿病に対する新しい治療を開発することは、焦眉の課題です。我が国の糖尿病の大半を占める2型糖尿病の原因としては、膵B細胞からのインスリン分泌障害の占める割合が大きいことが臨床研究より明らかになっています。よって、2型糖尿病の病因を究明し糖尿病治療薬を創出するには、膵B細胞におけるインスリン分泌のメカニズムを明らかにすることが必要です。私たちは、分子スイッチであるGタンパク質に着目し、膵B細胞でインスリンを蓄えている小胞(インスリン顆粒)の動態が時間的・空間的にどのように制御されているのかを解析しています。
|
|
Gタンパク質は、GTP型が活性型(スイッチのオン)でGDP型が不活性型(スイッチのオフ)とこれまで考えられてきました。私たちは、GDP型のGタンパク質(Rab27a)に結合し、下流にシグナルを伝える分子(coronin3、IQGAP1)を世界に先駆けて発見しました。私たちは、「GDP型依存性エフェクター」の概念を提唱し、低分子量Gタンパク質ではどのくらい普遍的な現象であるのかを検討しています。
|
|
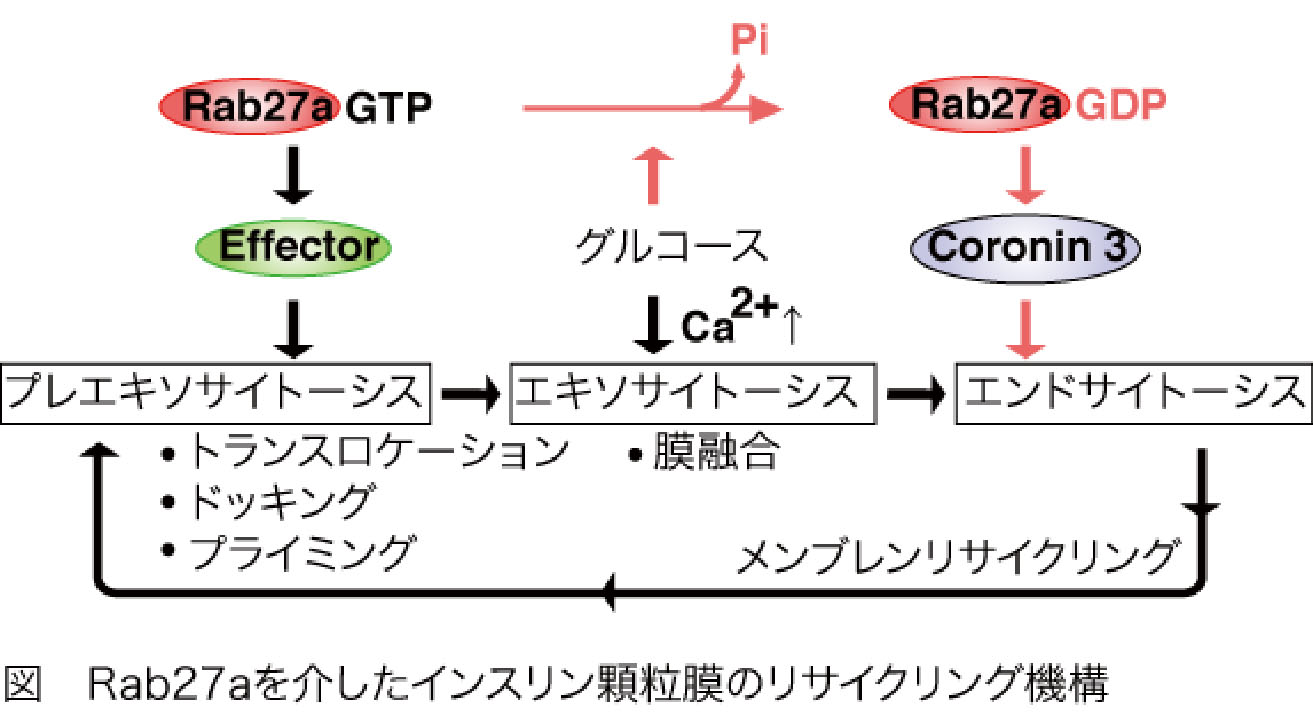
さらに私たちは、開口放出により細胞膜に融合したインスリン顆粒膜を再び細胞内に取り込むことで(エンドサイトーシス)、細胞の容積を分泌後も一定に保つメカニズムを明らかにしました。インスリン分泌刺激であるグルコースは、同時にエンドサイトーシスに関わるタンパク質群(coronin3とRab27a)を足場タンパク質(IQGAP1)を介して細胞膜近傍にリクルートします。リクルートされたcoronin3は、GDP型Rab27aと結合することで細胞骨格(アクチン)を束ね、エンドサイトーシスを制御することがわかりました。これは、GDP型依存性エフェクターのシグナル伝達を明らかにした最初の報告です。
|
|
グルコースによりRab27aがGDP型に変換される私たちの結果と合わせると、GTP型とGDP型間でのRab27aの「サイクリング」は、膵B細胞内での顆粒膜の「リサイクリング」と同期していることを示しています。インスリンの開口放出、あるいはその上流に介在する分泌機構に関する報告は枚挙にいとまがありません。しかし、エンドサイトーシスの制御はほとんど手がつけられていないと言って過言ではありません。私たちは、開口放出後のインスリン顆粒膜の動態とその制御機構の解明から、インスリンの新しい分泌制御機構を明らかにすることを目的としています。
- Yamaoka M, Ando T, Terabayashi T, Okamoto M, Takei M, Nishioka T, Kaibuchi K, Matsunaga K, Ishizaki R, Izumi T, Niki I, Ishizaki T, Kimura T. PI3K regulates endocytosis after insulin secretion by mediating signaling crosstalk between Arf6 and Rab27a. J. Cell Sci., 129, 637-49, 2016
- Yamaoka M, Ishizaki T, Kimura T. Interplay between Rab27a effectors in pancreatic beta-cells. World Journal of Diabetes, 6, 508-16, 2015
- Yamaoka M, Ishizaki T, Kimura T (2015) GTP- and GDP-dependent Rab27a effectors in pancreatic beta-cells. Biological and Pharmaceutical Bulletin, 38, 663-8
- Kimura T, Yamaoka M, Taniguchi S, Okamoto M, Takei M, Ando T, Iwamatsu A, Watanabe T, Kaibuchi K, Ishizaki T, Niki I. Activated Cdc42-bound-IQGAP1 determines the cellular endocytic site. Molecular and Cellular Biology, 33, 4834-43, 2013
- 木村俊秀、山岡真美 「GDP型Gタンパク質シグナリング」 生化学、85、1079-83
- 山岡真美、岡本光弘、仁木一郎、木村俊秀 「Rab27a-GAP新規結合タンパク質の同定とその機能解析」 日本病態生理学会雑誌 21, 3, 28-30, 2012
- Kimura T, Niki I. Rab27a in pancreatic beta-cells, a busy protein in membrane trafficking. Progress in Biophysics and Molecular Biology, 107, 219-23, 2011
- Kimura T, Niki I. Rab27a, actin and beta-cell endocytosis. Endocr. J., 58, 1-6, 2011
- Kimura T, Niki I. Rab GTPases control membrane recycling in pancreatic β-cells. Beta Cells: Functions, Pathology and Research, Gallagher SE (ed.), Nova Biomedical, NY, 123-30, 2011
- Kimura T, Taniguchi S, Toya K, Niki I. Glucose-induced translocation of coronin 3 regulates the retrograde transport of the secretory membrane in the pancreatic β-cells. Biochem. Biophys. Res. Commun., 395, 318-23, 2010
- Kimura T, Taniguchi S, Niki I. Actin assembly controlled by GDP-Rab27a is essential for endocytosis of the insulin secretory membrane. Arch. Biochem. Biophys., 496, 33-7, 2010
- 木村俊秀、仁木一郎 「インスリン分泌過程研究の変遷」Islet Equality 4, 3-5, 2010
- Kimura T, Kaneko Y, Yamada S, Ishihara H, Senda T, Iwamatsu A, Niki I. The GDP-dependent Rab27a effector coronin 3 controls endocytosis of secretory membrane in insulin-secreting cell lines. J. Cell Sci., 121, 3092-8, 2008
|
 |
硫化水素(H2S)の膵B細胞機能への影響
|
|
有毒ガスのイメージが強い硫化水素ですが、このガスは生体内でも産生され細胞内外の情報伝達を担うガスメッセンジャーです。細胞や組織における硫化水素の役割については、この5年で発表された論文は枚挙にいとまがありません。様々な細胞で確認された、硫化水素の共通する作用をあえて大まかに分類すると、1)細胞の活動性に関する作用と、2)細胞の生死に関する作用に大別できます。
私たちは、インスリンを分泌する膵B細胞を用いて硫化水素の作用を検討し、これまでにいくつもの知見を世界に先駆けて報告してきました。たとえば、1)硫化水素が膵島からのインスリン分泌を抑制すること(Diabetes, 2006)、2)高グルコースにより誘導された膵B細胞死を硫化水素が抑制すること(BBRC, 2013)、3)硫化水素産生酵素CSEにより作られた硫化水素が膵B細胞のインスリン分泌機能を保持すること(FEBS Lett., 2009)、4)硫化水素は酸化ストレスによる膵B細胞死を抑制するが、小胞体ストレスには影響しないこと( Br. J. Pharmacol., 2011)などです。さらに、グルコースでCSEが誘導されることを示し、その分子メカニズムを解明しました(Mol. Cell. Endocrinol., 2012)。この知見は、生理的な物質による硫化水素産生酵素の発現誘導を示した世界初の報告であり、硫化水素の誘導性産生の可能性を切り拓いた、重要な報告です。 |
|
これらの成果から私たちは、硫化水素は短期的にはインスリン分泌を抑制はするものの、長期的には膵B細胞に保護的に働くのではないかという仮説を立て、その実証を進めています。硫化水素関連物質は、主に循環器領域において盛んに研究されており、一部では医療応用への期待も膨らんでいます。
- Okamoto M, Ishizaki T, Kimura T. Protective effect of hydrogen sulfide on pancreatic beta-cells. Nitric Oxide, 46, 32-6, 2015
- Okamoto M, Yamaoka M, Takei M, Ando T, Taniguchi S, Ishii I, Tohya K, Ishizaki T, Niki I, Kimura T. Endogenous hydrogen sulfide protects pancreatic beta-cells from a high-fat diet-induced glucotoxicity and prevents the development of type 2 diabetes. Biochem. Biophys. Res. Commun., 442, 227-33, 2013
- 木村俊秀、岡本光弘.「硫化水素による膵B細胞保護」 DOJIN NEWS、148、1-4, 2013
- Yamamoto J, Sato W, Kosugi T, Yamamoto T, Kimura T, Taniguchi S, Kojima H, Maruyama S, Imai E, Matsuo S, Yuzawa Y, Niki I. Distribution of hydrogen sulfide (H2S)-producing enzymes and the roles of the H)S donor sodium hydrosulfide in diabetic nephropathy. Clin Exp Nephrol, 17, 32-40, 2013
- 岡本光弘、山岡真美、木村俊秀.「硫化水素と膵B細胞機能」 日本臨床、71、175-80, 2013
- 仁木一郎. 「膵B細胞における硫化水素産生と細胞保護作用」 日本薬理学会誌 139、13-6, 2012
- Taniguchi S, Kimura T, Umeki T, Kimura Y, Kimura H, Ishii I, Itoh N, Naito Y, Yamamoto H, Niki I. Protein phosphorylation involved in the gene expression of the hydrogen sulphide producing enzyme cystathionine γ-lyase in the pancreatic β-cell. Molecular and Cellular Endocrinology, 350, 31-8、2012
- Taniguchi S, Niki I. Significance of hydrogen sulfide production in the pancreatic beta cell. J. Pharmacol. Sci., 116, 1-5, 2011
- Taniguchi S, Kang L, Kimura T, Niki I. Hydrogen sulphide protects mouse pancreatic β-cells from cell death induced by oxidative stress, but not by endoplasmic reticulum stress. Brit. J. Pharmacol., 162, 1171-8, 2011
- Kaneko Y, Kimura T, Taniguchi S, Souma M, Kojima Y, Kimura Y, Kimura H, Niki I. Glucose-induced production of hydrogen sulfide may protect the pancreatic beta-cells from apoptotic cell death by high glucose. FEBS Letters, 583, 377-82, 2009
- 金子雪子、木村俊秀、仁木一郎. 「硫化水素とインスリン分泌」 内分泌・糖尿病科 25(3)、科学評論社、245-9, 2007
- Kaneko Y, Kimura Y, Kimura H, Niki I. L-cysteine inhibits insulin
release from the pancreatic β-cell; possible involvement of metabolic production
of hydrogen sulfide, a novel gasotransmitter. Diabetes 55, 1391-7, 2006
- 仁木一郎. 「硫化水素は第3のガス性シグナル分子か?」 日本薬理学会誌 128、195, 2006
- 仁木一郎、金子雪子. 「L-システイン代謝と硫化水素(H2S):インスリン分泌を抑制するシグナリング」 日本薬理学会誌 128、214-8, 2006
|
 |
| |
糖尿病モデルマウスを用いた膵B細胞の疲弊抑止と糖尿病治療への応用(名古屋大学との大学間共同研究)
カルモジュリンは最も普遍的なカルシウム結合蛋白質であり、膵B細胞においては、かつて分泌をコントロールすることが主な役割と考えられていました。ところが膵B細胞選択的にカルモジュリンを過剰発現させたマウスは、意外なことに膵B細胞が急激に著しく減少し糖尿病を発症しました。私たちは、このマウスにおける膵B細胞の減少がCa2+流入によってひきおこされるアポトーシスによることを突き止めました。さらに、その過程にはNOが関連していることを明らかにしています。私たちは、このトランスジェニックマウスが2型糖尿病における膵B細胞疲弊のモデルとして考えられることを提唱し、さらに膵B細胞においてcAMPを増やすPACAPが、このモデル動物の膵B細胞量減少を阻止することを報告しました。このような作用機序は、2型糖尿病の治療戦略になるものと考えています。また、私たちは体液性や神経性のインスリン分泌調節異常を伴う新しい糖尿病モデルの作出にも携わっています。これらのモデル動物を用いて糖尿病の発症機序と治療、さらには合併症の成因に関する研究を展開しています。
- 仁木一郎(2010)「スルホニル尿素薬のあゆみ」糖尿病の最新治療、フジメディカル出版、162-7
- 仁木一郎、谷口繁生、木村俊秀(2010)「インクレチン関連薬の何が期待されているのか」Jpn. J. Clin. Pharmacol. Ther., 41,
55-6
- 仁木一郎(2009)「インクレチンによる細胞量の調節」月刊糖尿病「別冊・インクレチン」(稲垣暢也編)、医学出版、37-44
- Yuzawa Y, Niki I, Kosugi T, Maruyama S, Yoshida F, Takeda M, Tagawa Y, Kaneko Y, Kimura T, Kato N, Yamamoto J, Sato W, Nakagawa T, Matsuo S (2008) Diabetic nephropathy in transgenic mice overexpressing beta cell calmodulin. J. Am. Soc. Nephrol., 19, 1701-11
- Tsunekawa S, Yamamoto Y, Tsukamoto K, Itoh Y, Kaneko Y, Kimura T, Ariyoshi Y, Miura Y, Oiso Y, Niki I (2007) Protection of pancreatic beta cells by exendin-4 may involve the reduction of endoplasmic reticulum stress; in vivo and in vitro studies. J. Endocrinol. 193, 65-74.
- 仁木一郎(2006)膵B細胞とカルモジュリン;膵B細胞選択的カルモジュリン過剰発現マウスを中心に.『内分泌糖尿病科』科学評論社、23(3)、318-22.
- Tsunekawa S, Miura Y, Yamamoto N, Itoh Y, Ariyoshi Y, Senda T, Oiso Y,
Niki I (2005) Systemic administration of pituitary adenylate cyclase-activating
polypeptide maintains beta-cell mass and retards onset of hyperglycemia
in beta cell-specific calmodulin-overexpressing transgenic mice. Eur. J.
Endocrinol. 152, 805-11.
- Horio F, Teradaira S, Imamura T, Anunciado RVP, Kobayashi M, Namikawa T,
Niki I (2005) HND mouse, a non-obese model of type 2 diabetes with impaired
insulin secretion, Eur J Endocrinnol 15, 971-9.
- 仁木一郎(2003)多様化する糖尿病治療戦略のための研究基盤. 日本薬理学会誌、122、228-35.
- Yu W, Niwa T, Miura Y, Horio F, Teradaira S, Ribar TJ, Means AR, Hasegawa
Y, Senda T, Niki, I (2002) Calmodulin overexpression causes Ca2+-dependent apoptosis of pancreatic beta cells which can be prevented by
inhibition of nitric oxide synthase. Lab Invest 82, 1229-39.
- Niwa T, Nimura Y, Niki I (2001) Lack of effects of incretin hormones on
insulin release from pancreatic islets in the bile duct-ligated rats. Am
J Physiol 280, E59-64.
 |
 |
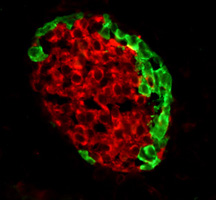
マウス膵島組織像
赤:インスリン,緑:グルカゴン |
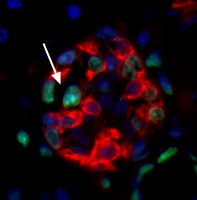
TUNEL法による膵B細胞アポトーシス像
赤:インスリン,緑:TUNEL,青:DAPI |
|
 |
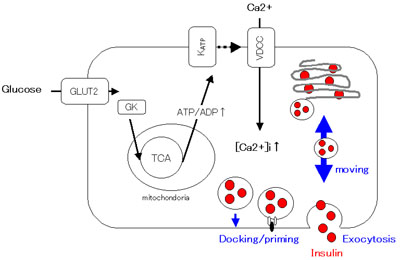
開口放出上流におけるインスリン分泌調節
膵B細胞内で作られたインスリン顆粒が細胞の外へ放出されるまでには、複数のステップが介在しています。私たちは、生きたままの膵B細胞の細胞質内を、インスリン顆粒が運動する様子を観察しました。インスリン顆粒は、細胞骨格と思われる細胞質内の構造上を往復運動しています。この顆粒運動は、インスリン分泌に関連するいくつかの物質によって影響されることを明らかにしました。この運動は、(細胞外からのCa2+流入ではなく)細胞内Ca2+遊離およびcAMPにより活性化されることを明らかにしました。インスリン分泌を増やす各種のセカンドメッセンジャーが膵B細胞内で起こす反応としては、蛋白質のリン酸化が早くから注目されてきました。私たちは、プロテインキナーゼAやミオシン軽鎖リン酸化酵素がインスリン顆粒の運動調節において、また、プロテインキナーゼC(novel
PKC)がインスリン顆粒の細胞膜とのドッキングにおいてと、開口放出上流において、各々のキナーゼが別のステップに働いていることを明らかにしました。
- 仁木一郎(2008)膵β細胞のグルコース認識と分泌経路『新時代の糖尿病学1』日本臨床社、145-9
- 仁木一郎(2006)インスリン分泌とプロテインキナーゼ.『糖尿病学』(門脇 孝、石橋 俊、佐倉 宏、野田光彦、戸辺一之編)西村書店、93-6.
- Niki I, Niwa T, Yu W, Budzko D, Miki T, Senda T (2003) Ca2+-influx does not trigger glucose-induced traffic of the insulin granules
and alteration of their distribution. Exp Biol Med 228, 1218-26.
- Niki I, Senda T (2002) Regulation of insulin release at pre-exocytotic
stages of the secretory machinery. Current Medicinal Chemistry 2, 219-31
- 仁木一郎 (2002)プロテインキナーゼによるインスリン顆粒動態の制御. 分子糖尿病学の進歩2002、(矢崎義雄 監修、門脇 孝、春日雅人、清野
進、渥美義仁、編集)金原出版、16-9.
- Niwa T, Fukasawa T, Yu W, Nimura Y, Senda T, Ohgawara H, Niki I (2001)
Characterization of secretory and morphological properties of primary cultured
endocrine cells from porcine pancreata. Pancreas 22, 135-40.
- Yu W, Niwa T, Fukasawa T, Hidaka H, Senda T, Sasaki Y, Niki I (2000) Synergism
of protein kinases A, C and myosin light chain kinase in the secretory
cascade of the pancreatic beta-cell. Diabetes 49, 945-52.
- 仁木一郎 (2000)インスリン分泌調節機構:分泌カスケードの解析と創薬の可能性. 日本薬理学会誌、115、329-35.
- Niki I (1999) Ca2+ signalling and secretory cascade in the pancreatic beta-cell. Jpn J Pharmacol 80, 191-7.
- Niki I, Hisatomi M (1997) Analysis of the secretory granule movement in
the pancreatic beta-cell : regulation by intracellular messengers. Jpn
J Physiol 47, Suppl 1, S25-6.
- Hisatomi M, Hayakawa T, Hidaka H, Niki I (1997) Modulation of Tyrosine
kinase activity has multiple actions on insulin release from the pancreatic
β-cell : Studies with lavendustin A. Jpn. J. Pharmacol., 74, 203-8.
- Iida Y, Senda T, Matsukawa Y, Onoda K, Miyazaki J-I, Sakaguchi H, Nimura
Y, Hidaka H, Niki I (1997) Myosin light chain phosphorylation controls
insulin secretion at a proximal step in the secretory cascade. Am J Physiol 273, (Endocrinol. Metab. 36), E782-9
- Hisatomi M, Hidaka H, Niki I (1996) Ca2+/calmodulin and cAMP control movement of secretory granules through protein
phosphorylation/dephosphorylation in the pancreatic β-cell. Endocrinology 137, 4644-9.
 開口放出上流におけるインスリン分泌調節
開口放出上流におけるインスリン分泌調節 |
 |
悪性腫瘍の分子イメージング(放射線科学教室との学内共同研究)
画像診断の進歩は、これまで困難とされてきた疾患の早期診断を可能にしつつあります。私たちは腫瘍特異的なモノクローナル抗体を放射性物質でラベルし、これをトレーサーとしてin
vivoにおける悪性腫瘍のシンチグラムを動物実験レベルで試みています。
- Matsumura K, Niki I, Tian H, Takuma M, Hongo N, Matsumoto S,Mori M (2008) Radioimmunoscintigraphy of pancreatic cancer in tumor-bearing athymic nude mice using 99mtechnetium-labeled anti-KL-6/MUC1 antibody. Radiation Medicine, 26, 133-9
|
|
|
|
|



