狂犬病、狂犬病ワクチンについて
大分大学医学部微生物学講座
教授 西園 晃
はじめに
狂犬病の存在とそれがもたらす恐怖は古代から知られてきたが、近世以降都市が形成されて以降オオカミやキツネなどから都市の畜犬の間に入り込み拡がるに及んで、人類は直接的に狂犬病の恐怖に晒されることになった。ルイ・パスツールは、狂犬病の臨床的観察から、その病態は神経系にあると見抜き、狂犬の脳を乳剤として健康犬または家兎の脳内に直接接種するという方法でその推定を実証した。1885年には狂犬病に罹患させたウサギの脳脊髄を乾燥させることによって弱毒化(不活化)したものを繰り返し接種して免疫することで、狂犬病のイヌに咬まれた少年を助けることに成功した。彼が狂犬病ウイルス野外株(街上毒)をウサギの脳脊髄で連続継代することにより確立した固定毒(街上毒では不定であった潜伏期が継代により”固定”化されることに由来)は、現在もその系統が受け継がれ、ワクチン株として使用されている。これが近代狂犬病学の出発点である(1)。
疫学
狂犬病は狂犬病ウイルスの感染により引き起こされる致死性の中枢神経系人獣共通感染症で、全ての哺乳動物が感受性を有し感染しうる。世界的に見れば狂犬病が発生していない国は日本、北欧諸国、英国、アイスランドなどごく一部で、これらを除き全世界に常在している(図1)。ヨーロッパ諸国や北米ではキツネ、アライグマ、コウモリなど野生動物がその宿主となる。特にコウモリは狂犬病ウイルスとともに類似のリッサウイルス属ウイルスに感受性があり狂犬病保有動物として重要である。一方アジア、アフリカでは、主に都市部のイヌの間での流行が主である。狂犬病ウイルスは人間の生活する環境に非常に近いところに存在するが、その一方でイヌをはじめとする家畜以外の野生動物にも感受性があることが、自然界におけるこの疾患の根絶の困難さを物語っている。
WHOにより報告される世界における狂犬病による死亡者数は約55,000人とされるが、主に都市から離れた農村部での報告が多く、その発生数を正確につかむことは困難である。患者の多くはアジアやアフリカでの発生で、なかでもインドでの死者数は20,000人前後と予想され、この他バングラデシュ、中国などでの発生が多い(2)。
我が国では、1950年に制定された狂犬病予防法により、飼い犬の登録、年1回のワクチン接種義務と野犬の抑留駆除の徹底、さらに島国で感染した野生動物がほとんど生息していないという特性から、1954年の発生からほぼ半世紀以上狂犬病発生の無い清浄国として経過してきた。その後現在まで1970年にネパールからの輸入感染例1例と、2006年フィリピンから2例の輸入発症例が報告された。今後はグローバル化や海外旅行者の増加に伴い常在地での感染、検疫を紛れて不法に入国した動物からの感染など、再びこの疾患に直面する可能性があり、なかでもアジア各国はいまだ狂犬病の主たる流行国であるという認識を持つことが重要である。
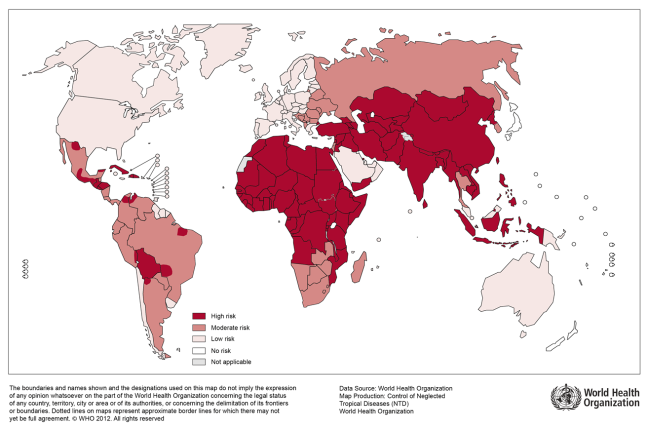
図1 世界における狂犬病リスク地域(WHO)
出典: WHOのページより(2020/7閲覧可能を確認)
出典: WHOのページより(2020/7閲覧可能を確認)
ウイルス学的特徴
狂犬病ウイルスはモノネガウイルス目、ラブドウイルス科のリッサウイルス属に属し、ビリオンは砲弾型またはキャップ型の特異な形状(図2)でエンベロープを有している。ゲノムは約12,000塩基のnegative極性の一本鎖RNAで、5種類の蛋白質(N: nucleoprotein, P: phosphoprotein, M: matrix protein, G: glycoprotein, L: RNA polymerase)をコードしている。このうちN蛋白はウイルス粒子内部に存在し、ゲノムの保護と複製開始に重要な役割を担っており、分離株間でアミノ酸配列が良く保存されているため、分子疫学的検討に利用される。G蛋白はウイルス粒子の最表層にスパイク蛋白として存在し、細胞のレセプターと結合して感染に関わる重要な蛋白である。また感染防御抗原としてワクチンのターゲットとして重要であると同時に、ウイルスの神経病原性にも深く関わっている。P蛋白はウイルスのRNAポリメラーゼであるL蛋白と共に共因子として転写と複製に関与するとともに、自然免疫系を制御する機能を有しており、強毒型ウイルスではIRF-3の誘導を阻害し、I型IFNの産生を阻害する。このため有効なウイルス排除のための自然免疫応答が誘導されず、ウイルスの神経組織への侵入を許すことが予想されている(3)。M蛋白はウイルスの粒子形成に関与している。
これまでリッサウイルス属には、狂犬病類似で血清学的には異なるウイルスの存在がコウモリなどで報告されている。現在リッサウイルス属には古典的な狂犬病ウイルスとは別に、狂犬病と臨床的に区別をつけがたい疾患を起こすいくつかのウイルスが含まれており、アフリカ、ヨーロッパ、オーストラリア、中央アジア、ロシアで散発的な発生が報告されている。現実にはコウモリとの接触で狂犬病が伝播した例はしばしば報告されているが、一般に咬傷自体が軽微であり、それとは自覚されないことも多い(4)。
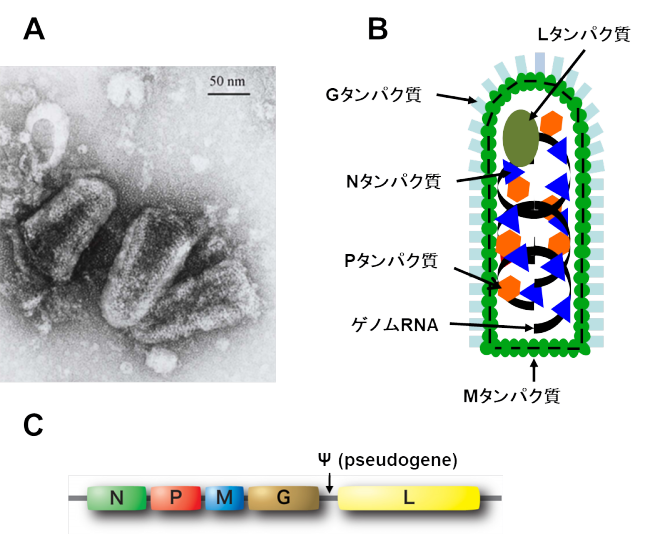
図2 (A)狂犬病ウイルス粒子の電子顕微鏡像、(B)狂犬病ウイルス粒子の模式図、(C)ゲノム構造
病態、特に発症病理機構と臨床症状
狂犬病は感染症法4類感染症全数把握疾患(三種病原体)に分類され、他のリッサウイルスによる感染でも同様の症状を呈する。ウイルスは通常、咬傷(感染)部位から侵入し、ゆっくりと増殖して末梢神経の末端から神経系に入り、脊髄、脳に到達する。発症までの潜伏期間は咬傷部位や程度で異なり、傷が頭部に近いほど短いが、患者の約60%では平均すると30日から90日が多いが、なかには1年以上に及ぶ例もある。特殊例として、洞窟などで霧状になった感染コウモリの唾液を吸い込むことで感染した例や原因不明の脳炎で死亡した患者からの角膜移植後、実質臓器移植後に狂犬病を発症した例もある(5)。
臨床症状の基本はウイルス性脳炎である。ウイルスが中枢神経系で増殖するとその後は遠心性に角膜、唾液腺、内臓、筋肉、皮膚など全ての臓器に広がる。潜伏期を過ぎ、前駆期に入るとウイルスの中枢神経での増殖とともに、全身倦怠感、食欲不振などの非特異症状が、特徴的な前駆症状として咬傷部の灼熱感、疼痛や痒みなどの知覚異常がある。前駆期に続いて幻覚、幻視、興奮、躁動などを主症状とし、呼吸困難、嚥下困難さらには恐水症状に陥り、興奮期の最も目立つ症状である。さらに極度の不安感、衝動的な動作、諸感覚器の過敏、分泌機能亢進、筋緊張、腱反射の亢進といったものが狂躁型狂犬病の興奮期をかたちづくる。恐水症状は、水を飲む際に嚥下困難を起こし、苦しみ飲み込めず、甚だしい場合コップの水を見たり、水の音がするだけでもそれを避けるようにして苦しむ。また、送風機からの風などに過敏に反応しこれを避けようとする場合もある(恐風症)。狂犬病のほぼ8割がこの狂躁型であるが、これに対し狂躁状態がなく、最初から麻痺症状を呈するものを麻痺型狂犬病と呼ぶ。いずれの場合でも最終的には脳神経や全身の筋肉麻痺をきたし、ほぼ100%が死亡する。麻痺型の場合で動物咬傷の不明な場合などでは、生前診断は困難である。またヒトの狂犬病症例の多くは15歳以下の小児で、咬傷の部位も頭部や顔面などに多く、潜伏期も短く発症の危険性も高い。
いずれの病型でも、狂犬病症状がひとたび明らかになったら有効な治療・救命法はないが、最近米国でコウモリによる感染から発症した少女が、ワクチンなどの生物製剤の投与によらず複数の抗ウイルス剤の投与と人工的な昏睡状態の導入で救命し得た例が報告され、今後の動向が期待される(6)。
診断および鑑別診断
実際の臨床の場では、鑑別診断項目の一つとして念頭に置きつつ、海外渡航そして常在地で動物に咬まれた病歴から脳炎症状、典型的な恐水症状などを参考にして診断を下す必要があるが、麻痺型狂犬病や動物咬傷の不明な場合では診断に苦慮する場合も多い。生前の実験室内診断としては、頭頚部皮膚の生検材料や角膜スメアーなどを用いて、抗N抗体を用いた蛍光抗体法によるウイルス抗原の検出が行われる。また生検材料や唾液を用いて、ゲノム配列上保存性の高いN遺伝子配列内にプライマーを設定し、RT-PCR法でウイルスゲノムを検出する方法も用いられる。血清診断や髄液診断は、ウイルス抗体価が死亡直前まで上昇してこないので役立たない。古くは死亡後の脳の病理組織学的検索によりHE染色でエオジン好性の細胞質内封入体(ネグリ小体)を観察することが行われた。
治療・予防と予後
前述のように発症した場合の死亡率はほぼ100%なので、感染の機会があった場合には、傷口の充分な洗浄とそれに引き続く曝露後発症予防ワクチン接種により発症を押さえることが肝要である(7)。
a. 暴露後ワクチン接種
曝露後に用いるワクチンとしてWHOは、組織培養ワクチンを使用するように推奨している。これらは培養細胞で増殖させたウイルスをベータプロピオラクトンで不活化、濃縮・精製したものであり、現在、種ウイルスにPitman-Moore株を用いたヒト2倍体細胞ワクチン(HDC)(サノフィ社製)、同じ株を用いたVero細胞ワクチン(サノフィ社製)、種ウイルスにLEP-Flury株を用いた鶏初代胎児細胞ワクチン(Chiron社製)などが世界的に流通している。組織培養ワクチンが一般化するまでは、古くはパスツール以来の動物脳組織由来のワクチンが利用されてきたが、免疫原性が低くかつ副作用の頻度も高いことから組織培養型ワクチンへの転換がWHOにより進められている。ちなみにわが国では唯一、化学及血清療法研究所(化血研)が製造している鶏初代胎児細胞ワクチン(種ウイルスはHEP-Flury株)が生産され使用可能である(図3)。
WHOが推奨する標準的な曝露後免疫のスケジュールは、最初の注射を0日として、以後3日、7日、14日、28日の計5回、各1 mL、2.5国際単位の組織培養ワクチンを三角筋内に筋注する。もしカテゴリーIII、即ち大量のウイルス感染の疑いがある場合や、頭部に近い部位への咬傷の場合は後述の体重1kgあたり20単位のヒト抗狂犬病免疫グロブリン(ウマのグロブリン製剤では40単位)の咬傷部位への浸潤と筋注を併せて行う。しかし両グロブリン製剤とも生産量は僅少であり、日本国内でも在庫がほとんど無い。
また接種方法はこの他にも、0日のみ両側三角筋内に1mLづつ筋注し、以後7日、21日に一側のみに筋注を行う2-1-1 Zagreb法。さらに少量0.1mLを左右の上腕皮内に4回にわたり接種する方法(タイ赤十字方式、2-2-2-0-2法)などがある。曝露後の処置の程度は表1に沿って行うように推奨される。
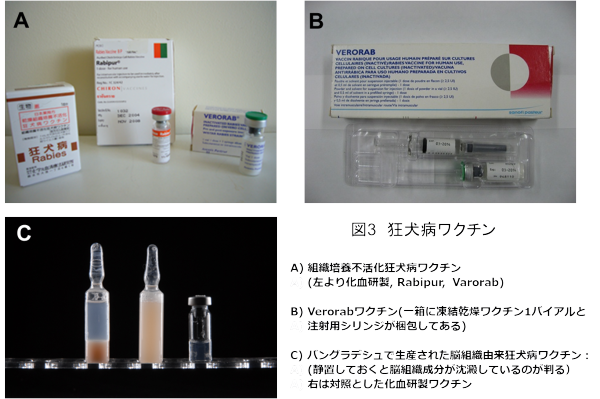
図3 各種狂犬病ワクチン
表1 WHOが規定する接触・曝露の種類と推奨される曝露後発病予防治療
| カテゴリー | 曝露 | 動物との接触状況 | 推奨治療 |
| I | なし | 動物を撫でる、餌をやる (傷や病変のない部分を)舐められる |
接触歴が信頼できるなら治療不要 |
| II | 軽微 | 素肌を軽く咬まれる 出血のない小さな擦過傷 |
ワクチンを投与 | III | 重度 | 1カ所以上の皮膚を破る咬傷 傷のある皮膚を舐められる 唾液による粘膜汚染 コウモリへの曝露 |
免疫グロブリンとワクチンを投与 |
カテゴリーIIとIIIにおいて、治療開始は直ちに行なうのが推奨されている。
また、被疑動物の10日間の経過観察や実験室内診断で狂犬病陰性と判断されたら治療は中止してもよい。
b. 暴露前ワクチン接種
狂犬病ウイルスを扱う研究者や動物検疫関係者、あるいは流行地への立ち入りを予定する者はあらかじめ基礎免疫をしておくことが望ましい。ワクチン1バイアルを0日、7日、21あるいは28日に3回筋注することで、充分な中和抗体の産生が1-2年近く維持される。曝露前免疫済みでも不幸にして病獣から咬傷を受けた場合は、0日、3日にそれぞれ1回ずつ追加のワクチン接種を行い、中和抗体価を充分に再上昇(ブースト)させる必要がある(7)。
わが国の化血研製ワクチンの曝露前スケジュールは0日、28日、180日に皮下接種で行うことになっているが、これだと終了までに半年を要するため実際的でない。
おわりに
我々は最近、抗インフルエンザ薬として国内で承認されたファビピラビルが、狂犬病ウイルの増殖をin vitroで抑制し、実験的に末梢感染させたマウスに曝露後投与することでその発症を明らかに抑制させることを報告した(8)。今後不治の病である狂犬病の治療に新たな展開が開けるかもしれない。
日本は世界にもまれに見る狂犬病の清浄国である。これはわが国の地の利とイヌなどの登録・検疫制度を維持しうる国民の意識の高さがもたらしたものであり、今後も継続していかなければならない。しかし一歩国外に出ると、(特にアジアでは)狂犬病はありふれた感染症であり、イヌや野生動物との不用意な接触を持つことの危険性を改めて認識させるべきである。また動物からの咬傷を受けた場合の正しい対処法を知っておくべきである。
参考文献
- Jackson A C, Wunner WH: Rabies 2nd. Ed. Jackson AC, Wunner WH 2ed. Academic Press, An Elsevier Science Imprint, 2007.
- Knobel DL, Cleaveland S, Coleman PG, et al : Re-evaluating the burden of rabies in Africa and Asia. Bull World Health Organ 83(5): 360-8, 2005
- Brzozka K, Finke S, Conzelmann KK.: Inhibition of interferon signaling by rabies virus phosphoprotein P: activation-dependent binding of STAT1 and STAT2. J Virol. 80(6): 2675-83, 2006
- Warrell MJ, Warrell DA.: Rabies and other lyssavirus diseases. Lancet. 363(9413): 959-69, 2004
- Srinivasan A, Burton EC, Kuehnert MJ et al. Transmission of rabies virus from an organ donor to four transplant recipients. N Engl J Med. 352, 1103-11; 2005.
- WHO Expert Consultation on Rabies, Second report. World Health Organization. Tech. Rep. Ser. 982, 1-139. Geneva, 2013
- Willoughby RE Jr, Tieves KS, Hoffman GM, et al : Survival after treatment of rabies with induction of coma. N Engl J Med. 352(24): 2508-14, 2005
- Yamada K, Noguchi K, Komeno T, et al. Efficacy of favipiravir (T-705) in rabies post-exposure prophylaxis. J Infect Dis. 2016 213: 1253-1261.00
詳しく知りたい方へ
以下の日本語の総説がありますので、上記とあわせて参考にして下さい。うち2つはPDFで閲覧可能です。
- 西園 晃「狂犬病―最新の知見も含めて―」 モダンメディア 64(6): 213‐219. 2018
- 井上智,ほか「狂犬病の臨床と課題」 臨床とウイルス 45(5): 2017
- 西園、山田「Negative Strand RNA Virusのウイルス学 2.ラブドウイルス」 ウイルス 62(2): 183-196. 2012
