研究について
他施設CRBで特定臨床研究の審議を受ける方へ
-当院が共同研究施設(分担施設)-
他施設のCRB(認定臨床研究審査委員会)にて受審される場合は、以下の手続きを行って下さい。
1.事前提出資料の作成(CRB前)
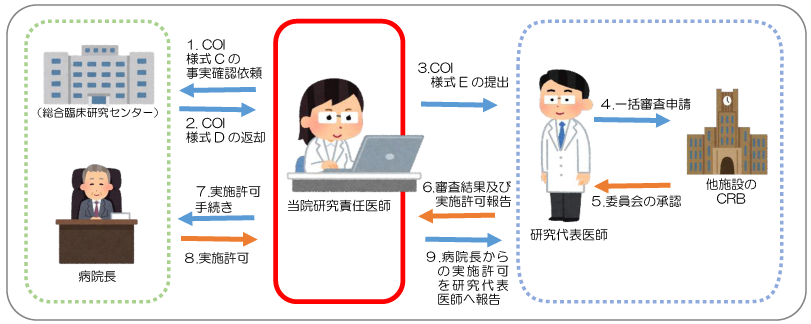
研究事務局から送られてくる利益相反管理様式(様式C)の事実確認を行いますので、
電子(Excel)で研究責任医師・分担医師全員分をgcrcjimu@oita-u.ac.jpまでお送りください。事実確認後、様式Dをお返しします。
そのほか、研究代表医師の指示に従って必要書類の作成・提出等を行ってください。
様式C:利益相反自己申告書
様式D:利益相反状況確認報告書
様式E:利益相反管理計画
2.他施設のCRBで審査
- 研究代表医師が、希望するCRBへ審査を申請します。
3.他施設のCRBでの承認
4.研究代表医師から共同研究施設(当院)への審査結果連絡
- 研究代表医師より共同研究施設(当院)の研究責任医師へ審査結果の連絡があります。
-
- ※注意
- この時点ではまだ研究を開始できません。
5.の手続きを行い、必ず当院病院長からの実施許可を得た後に開始してください。
5.病院長への研究実施許可申請
- 当院の研究責任医師は、病院長への研究実施許可を得るため、以下の書類を総合臨床研究センターへ提出して下さい。
- 実施・安全体制等の確認書
- 教育の履歴(ICRweb当該年度の大分大学コースの修了証 ※研究責任医師・分担医師全員)
- CRBで承認された書類一式
6.病院長からの実施許可(当院)
- 病院長による実施許可の判断後「臨床研究実施許可通知書」が研究責任医師へ発行されます。
7.病院長からの実施許可について研究代表医師へ報告
- 上記6の「臨床研究実施許可通知書」の写しを、研究代表医師へ提出して下さい。
8.研究開始後の報告関係
- jRCTの公表
- 定期報告
- 変更審査
- 疾病報告
- 重大な不適合報告
- 終了・中止報告
【本件に関する問い合わせ先】
総合臨床研究センター
TEL:6163 Mail:gcrcjimu@oita-u.ac.jp
- 大分大学医学部附属病院における特定臨床研究実施に係る標準業務手順書ダウンロード
