腎癌マウスモデル
腎淡明細胞癌(clear cell renal cell carcinoma: ccRCC)は組織学的核異型によってhigh grade群(G1, G2)とlow grade群(G3, G4)に分類され、high grade群はlow grade群よりも明らかに予後不良である。したがって、high grade 群とlow grade群では異なるゲノム異常の存在が想定される。私はこれまでccRCCのゲノムプロファイルをアレイCGH法を用いてゲノムワイドに解析し、最も高頻度(80%以上)に検出される3p lossはlow gradeとhigh grade間で検出頻度に差を認めなかったが、14q lossはlow gradeよりもhigh gradeで有意に高頻度に検出される(p<0.05)ことを発見した(J Pathol., Yoshimoto et al.,2007)(図1上)。つまり、3p lossはlow grade ccRCC発症に必須であり、それに14q lossが付加されることがhigh grade ccRCCへの悪性化に重要であることが強く示唆された。したがって、14q loss領域に存在してlossによって発現低下する遺伝子の中にはhigh grade ccRCCの病態に関わる癌抑制遺伝子が含まれる可能性が示唆された。さらに、私はこれらの知見にもとづいて14q loss領域を探索して、がん抑制遺伝子候補SAV1遺伝子を同定した(図 1下)(BMC cancer, Matsuura et al.,2011)。
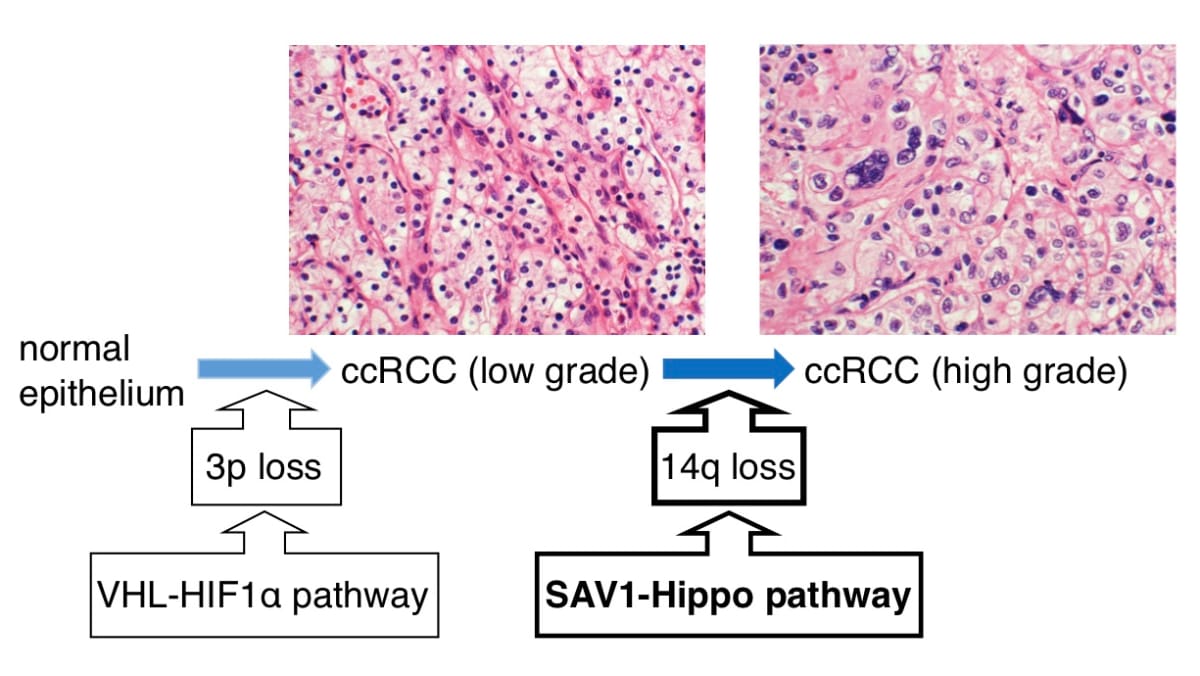
図 1 腎癌悪性化のメカニズム
上)
14q lossはhigh grade群に有意に多いことから、14q lossは3p lossを有するRCCに新たに加わったゲノム異常であると考えられた (J. Pathol, 2007, Yoshimoto, Matsuura et al) 。
下)
14q lossに伴い遺伝子発現の低下を認めるSAV1を同定した。SAV1およびHippoパスウェイが腎癌の悪性化に関わることが示唆された (BMC cancer, 2011, Matsuura et al) 。
SAV1遺伝子はHippoパスウェイ(図 2)のcore componentである。我々はSAV1遺伝子の腎特異的ノックアウトマウスを作製し、個体レベルでSAV1遺伝子の発現低下がどのように腎細胞癌の発癌や悪性化に関わるかを調べた。SAV1遺伝子が欠失しただけでは腎細胞癌は発症しなかったが、腎重量の減少と嚢胞形成、尿細管細胞数の増加、核異型が認められた(J Pathol., Kai et al.,2016)(図 3)。

図 2 Hippoパスウェイ
コア・コンポーネントとしてSAV1の他にMst1/2, LATS1/2があり、YAP1 (転写制御因子) をリン酸化し核内に移行することを阻止することによって、細胞の増殖を抑制し、アポトーシスを促進することが知られている。

図 3
SAV1コンディショナルノックアウトマウスの尿細管上皮細胞には核異型が見られる。
一方これまで、3pに存在するVHL遺伝子の遺伝子変異やメチル化による不活性化がHIF1の恒常的活性化をもたらし、その下流のVGEF, PDGFが活性化がccRCCの発癌に重要であると報告されてきた(Clark et al., Kid Int, 2009)。しかし、VHLの腎特異的ノックアウトマウスでは、腎嚢胞は形成されるが細胞異型等は認められていない。VHL+BAP1あるいはVHL+p53遺伝子のノックアウトマウスでは腎癌が認められるが(Albers et al.,EMBO Mol Med,2013) 、ヒト症例において腎癌では他の固形癌と異なりp53の遺伝子異常を示す症例は少ないこと、さらに腎癌悪性化には3p lossでなく14q lossが必要であることから、ノックアウトマウスで欠失させた遺伝子は、必ずしもヒトで認められるhigh grade ccRCCの遺伝子異常と一致していない。
実際のccRCC症例に見られる遺伝子異常を持つモデルマウスの作製こそが、予後不良なhigh grade ccRCCのメカニズムの解明と治療の開発に必須なのではないかということが核心的な問いである。