自主臨床研究を行う方へ
自主臨床研究について
「人を対象とする生命科学・医学系研究に関する倫理指針」が令和3年6月30日に施行されました。当院における自主臨床研究の取扱いが、下記のように変更になりましたのでご注意ください。また、臨床研究法の一部改正に伴い、特定臨床研究の対象範囲が変更されました。※詳細は厚生労働省ホームページをご覧ください。 申請先の委員会がご不明な場合は、判定フロー図をご確認ください。
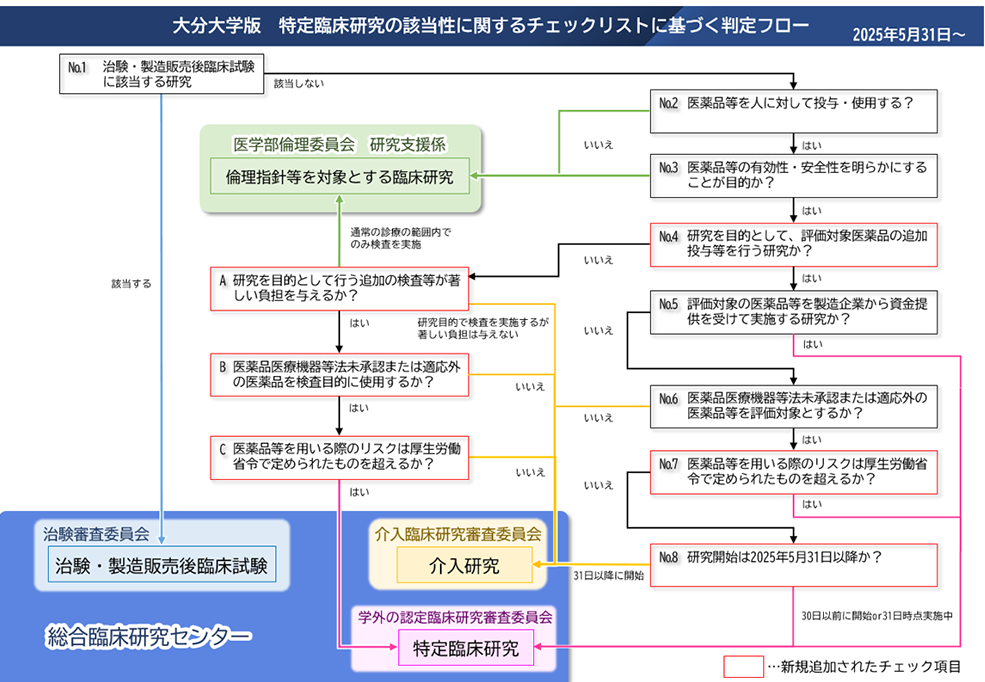
当院での臨床研究の審査は医学部倫理委員会、介入臨床研究審査委員会(以下、IRB)で行われており、当院で行う臨床研究は、どちらかの委員会に審査申請し、承認を受けなければなりません。
このうちIRBでは、主に介入を伴う研究を審査の対象としています。
ここで言う介入とは、
- 通常の診療を超えた医療行為であって、研究目的で実施するもの
- 通常の診療と同等の医療行為であっても、被験者の集団を原則として2群以上のグループに分け、それぞれに異なる治療方法、診断方法、予防方法、その他の健康に影響を与えると考えられる要因に関する作為又は無作為の割付けを行って、その効果等をグループ間で比較するものをさします。
また、観察研究であっても、医薬品、医療機器の有効性等を評価する研究の場合はIRBで審査を行うことがあります。
※臨床研究に関する同意書(原本=紙媒体)は責任医師が保管ください。他の研究への二重参加等を防ぐ為に、同意書(写)を電子カルテに取り込みください。ただし、臨床研究に関する同意書は電子カルテに取り込みをしても電子カルテを原本とする規程はありませんので、必ず原本は保管してください。また、カルテには付箋機能にて患者さんが研究に参加中である旨を貼付してください。
IRB申請まで
利益相反マネジメント委員会や保険への対応が必要となりますので早めの準備をお願いします。データセンター支援を依頼される場合は「データセンター業務依頼書」を総合臨床研究センター/統計・データセンター部門(内線6637)までIRB審議予定の2か月前を目処にご提出ください。
臨床研究倫理セミナーの受講、受講証の取得
- 1年に1度の受講が義務付けられています。IRB申請時に受講証の写しが必要です。受講ご希望の方はこちらから
保険会社による臨床研究の補償・賠償保険引き受けの可否と保険料提示
- 通常の診療を越えた医療行為を伴う研究は、IRB締切の4週間前までに保険に申し込む必要があります。保険会社への提出資料として試験計画書、同意説明文書が必要になります。 保険の申し込みに関しては、経営戦略課研究支援係(内線6327)にお問い合わせください。
利益相反マネジメント委員会の審議 ※書類提出について
- IRB申請前に利益相反マネジメントを受ける必要があります。利益相反マネジメント委員会の締切を早目にご確認ください。
様式・手順書等のダウンロード
- 単機関で実施する場合と多機関共同で実施する場合は、提出書類が異なりますのでご注意ください。
申請方法
申請書は、提出期限までにIRB事務局まで提出してください。
| 区分 | 代表/分担 | 申請先委員会※ | 申請方法 |
|---|---|---|---|
| 本院のみの単機関研究 | - | 本院IRB | 申請方法1 |
| 多機関共同研究 (それぞれの機関の委員会で審査の場合) |
代表/分担 | 本院IRB | |
| 多機関共同研究 (一括審査の場合) |
分担 | 他機関委員会 | 申請方法2 |
| 代表 | 本院IRB | 申請方法3 | |
| 他機関委員会 本学研究者が代表者だが,学外委員会へ申請する場合 |
申請方法4 (調整中) |
※本院IRBが担当するのは介入研究です。観察研究は倫理委員会へ申請してください。倫理委員会
研究の登録
- 介入を伴う研究は、研究実施前までに下記のいずれかへ研究の概要を登録してください。新指針 第6の4の(1)
- jRCT(Japan Registry of Clinical Trials: jRCT)【厚生労働省の公開データベース】
- 大学病院医療情報ネットワーク(UMIN)【臨床試験登録システム】
IRB審議から実施許可
IRB当日
- 口述説明(研究責任者または研究分担者)
承認後、結果通知書の発行~実施許可まで
- IRBで承認となった場合、研究責任者へ『承認』の結果通知書を発行します。その後、病院長の確認を経て研究実施許可通知書を発行します。研究責任者は、研究実施許可通知書受領後より研究の実施が可能です。
IRB指示事項への回答(条件付きで承認となった場合)
- 『条件付き承認』となった場合、臨床研究実施計画書等修正報告書(書式6:臨床研究)の提出が必要です。(書式6:臨床研究)をIRB事務局へご提出ください。

